
公司新聞
辭舊迎新 | 第5項!泉生生物“人臍帶間充質干細胞注射液治療慢性阻塞性肺疾病”獲得國家藥監局臨床默示許可!
2024年2月7日,在辭舊迎新,歡度龍年新春佳節之際,浙江泉生生物科技有限公司(簡稱“泉生生物”)自主研發的生物1類新藥“人臍帶間充質干細胞注射液”(受理號:CXSL2300795),正式獲得國家藥監局藥品審評中心(CDE)的藥物臨床試驗默示許可,這也是泉生生物獲得CDE批準的第5項干細胞臨床試驗項目。
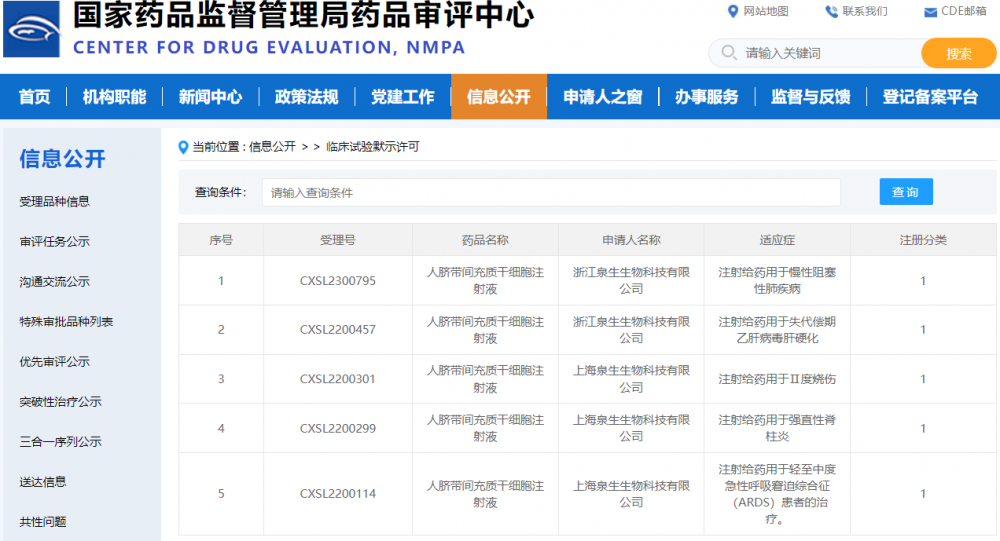
CDE官網:泉生生物已獲臨床試驗默示許可
第5次的臨床試驗默示許可,不僅是國家藥監局對于泉生生物科研技術能力的認可,也奠定了泉生生物在干細胞新藥研發領域的領先地位。在生物醫藥產業感受資本凌冽寒風的2023年,泉生生物在以令人驚喜的速度快速發展,但也面臨著更多的困難和挑戰。未來期望泉生生物不僅在干細胞治療領域取得更多輝煌業績,也期望在iPSC和免疫細胞等領域繼續努力探索行業新標準和新高度。
關于慢性阻塞性肺疾病
01慢性阻塞性肺疾病
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease ,COPD)是一種異質性肺部狀態,以慢性呼吸道癥狀(呼吸困難、咳嗽、咳痰)為特征,是由于氣道異常(支氣管炎,細支氣管炎)和/或肺泡異常(肺氣腫)導致的持續性(常為進展性)氣流阻塞。COPD確診標準為吸入支氣管舒張劑后仍有氣流受限,即吸入支氣管舒張劑后第1秒用力呼氣容積(FEV1)/用力肺活量(FVC)比值<0.7或低于正常預計值下限,并除外其他可引起氣流受限的疾病。
COPD是我國最常見的慢性呼吸系統疾病,患病率高,疾病負擔重。2018年,王辰院士牽頭的“中國成人肺部健康研究”調查結果顯示,我國20歲及以上成人慢阻肺患病率為8.6%,40歲以上人群患病率高達13.7%,估算我國患者數近1億,提示我國慢阻肺發病仍然呈現高態勢。世界衛生組織(WHO)預測,慢阻肺的患病率在未來40年將繼續上升,預測至2060年死于慢阻肺及其相關疾患者數超過每年540萬人。
02引起COPD的危險因素及發病機制
引起COPD的危險因素具有多樣性的特點,可概括為個體易感因素和環境因素共同作用:①個體因素,包括遺傳因素、年齡和性別、肺生長發育、支氣管哮喘和氣道高反應性等。COPD有遺傳易感性,α1?抗胰蛋白酶重度缺乏與非吸煙者的肺氣腫形成有關。年齡是COPD的危險因素,年齡越大,COPD患病率越高。②環境因素,包括煙草、燃料煙霧、空氣污染、職業性粉塵、感染和慢性支氣管炎等。吸煙是COPD最重要的環境致病因素。呼吸道感染是COPD發病和加劇的重要因素,病毒和(或)細菌感染是COPD急性加重的常見原因
COPD的發病機制復雜、尚未完全闡明。吸入煙草煙霧等有害顆粒或氣體可引起氣道氧化應激、炎癥反應以及蛋白酶/抗蛋白酶失衡等多種途徑參與慢阻肺發病。多種炎癥細胞參與COPD的氣道炎癥,包括巨噬細胞、中性粒細胞、以及Tc1、Th1、Th17和ILC3淋巴細胞等。此外,自身免疫調控機制、遺傳危險因素以及肺發育相關因素也可能在COPD的發生發展中起到重要作用。
03 目前COPD主要治療方式及缺陷
COPD治療主要包括以下三個方面:①減少吸煙、吸入有毒氣體或粉塵等的刺激;②藥物治療:支氣管舒張劑是慢阻肺的基礎一線治療藥物,多首選吸入治療。在使用1種或2種長效支氣管舒張劑的基礎上可以考慮聯合吸入糖皮質激素治療。③非藥物治療:非藥物干預與藥物治療起到協同作用,是穩定期COPD治療的重要組成部分,包括呼吸康復治療、家庭氧療、外科治療(肺移植、外科肺減容術)等。
盡管目前的治療手段可以緩解COPD癥狀,改善患者生活質量,但無法阻止COPD的進展,無法修復受損的肺組織及功能,難以逆轉肺功能的惡化。因此,迫切需要開發新型有效的COPD治療策略。
04干細胞治療COPD
多項臨床前研究證實了干細胞(主要集中在骨髓間充質干細胞、脂肪間充質干細胞、臍帶間充質干細胞)在COPD動物模型中有著良好的治療效果。目前已有多項干細胞治療COPD的臨床試驗探討了間充質干細胞治療COPD的安全性和有效性,為后續的干細胞治療COPD提供了良好的研究基礎。
干細胞治療COPD的主要作用機制:
抑制炎癥反應的發生:慢性阻塞性肺疾病是多種細胞及因子共同參與的慢性炎癥反應性疾病,間充質干細胞能夠降低炎癥因子的水平,減少炎癥反應的發生,機制可能為通過旁分泌機制發揮作用。
糾正蛋白酶-抗蛋白酶平衡失調:間充質干細胞可能通過激活炎癥反應的正反饋通路、抑制蛋白酶釋放從而糾正蛋白酶-抗蛋白酶的平衡失調狀態。
抑制細胞凋亡:間充質干細胞能夠通過多種途徑抑制細胞凋亡。
抑制氧化應激:氧化應激在慢性阻塞性肺疾病的發生發展中有非常重要的作用,間充質干細胞能夠降低氧化應激水平,并對細胞具有保護作用,能夠通過Wnt信號通路的激活,從而分化成肺泡上皮細胞。
干細胞治療未來展望
泉生生物自主研發的生物1類新藥 “人臍帶間充質干細胞注射液” 已按照治療用生物制品1類新藥要求完成臨床前藥學、藥理毒理研究,從臨床需求、質量可控性、非臨床有效性和安全性、既往臨床安全性等方面,均支持其進入臨床試驗。根據泉生生物已開展的干細胞臨床試驗數據表明,干細胞具有良好的安全性,并在相關疾病的療效顯示一定的獨特性和優越性。
泉生生物將始終從患者需求出發,堅持推出新藥研發,嚴格按照國家藥監局、GMP及GCP相關要求進一步完善相關研究,高質量推動干細胞產品臨床研究,確保并不斷提高產品安全性、穩定性和有效性,為保障群眾生命健康福祉,提高生命質量做出積極貢獻。

